Hier siehst du die molekulare Struktur der Teilchen von organischen Ausgangsstoffen, die für die Produktion weiterer Stoffe oder als Brennstoff verwendet werden. Auch die Summenformel kannst du hier nachlesen:
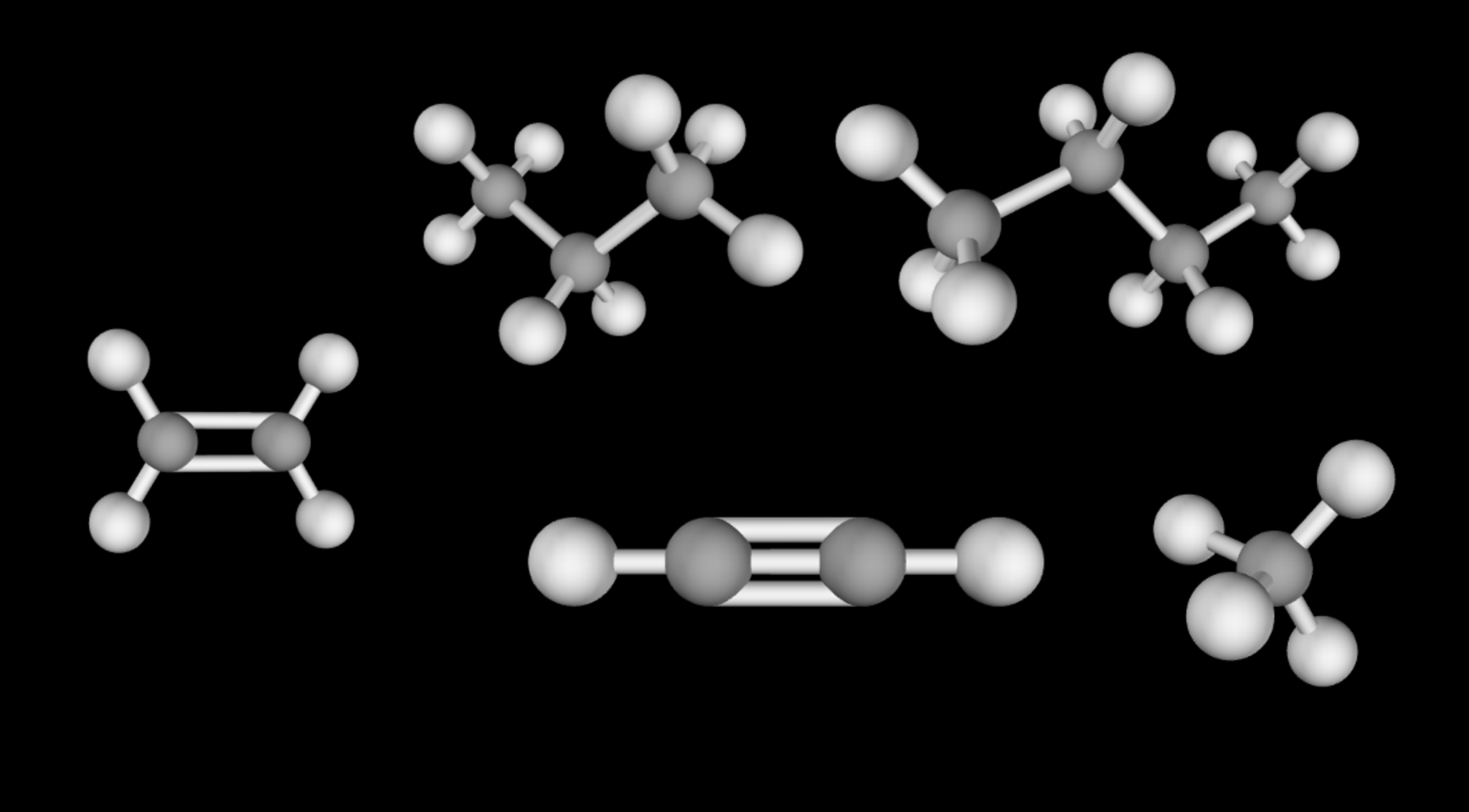
§
3. Molekulare Unterschiede bei Kohlenwasserstoffen
§
© Digitale Lernwelten GmbH
Molekularer Aufbau von organischen Molekülen
Zusatzwissen für Realschülerinnen und Realschüler
Zusatzwissen für Realschülerinnen und Realschüler
Jetzt bist du dran!
Hinweis: Für den Hauptschulbildungsgang ist nur die Summenformel verbindlich!
Moleküldarstellung auf Papier
Weil die Moleküle nicht nur dreidimensional betrachtet werden können, sondern auch gezeichnet werden müssen, zeichnet man die leicht seitlich nach vorne und hinten abstehenden Bindungen in einer Ebene. Das kannst du in der Abbildung erkennen. Dadurch erhält man die sogenannte Strukturformel.

§
© Digitale Lernwelten GmbH
Teste dein Wissen
Tipp: Der Hefteintrag kann dir dabei helfen
Ordne im Memory die Strukturformeln und Summenformeln einander zu!
(Hinweis: Für den Hauptschulbildungsgang ist nur die Summenformel verbindlich. Bearbeite die Übung dennoch, wenn du magst!)
Methan (CH4) ist ein farb- und geruchloses Gas. Es schmilzt bei −182,6 °C und siedet bei −161,7 °C. Methan ist der einfachste Vertreter der sogenannten Alkane. Es wird in Pipelines und Gasnetzen in Städten transportiert. Wenn ein Haus einen Gasanschluss besitzt, dann wird es mit Methangas versorgt. Damit wird dann die Heizung zum Wärmen der Wohnung oder der Gasherd zum Kochen betrieben. Methan verbrennt zu Kohlenstoffdioxid und Wasser. Es entsteht auch in Mooren und im Verdauungstrakt von Kühen.
Hier siehst du ein 3-D-Modell des Moleküls, das du in alle Richtungen drehen kannst:
Ethan (C₂H₆) ist ein farb- und geruchloses Gas. Es schmilzt bei -183,3 °C und siedet bei -88,6 °C. Genutzt wird das Gas hauptsächlich zum Heizen, aber auch als Kältemittel. Ethan dient außerdem als Ausgangsstoff für die Bildung von Ethen, das eine wichtige Bedeutung in der chemischen Industrie hat.
Hier siehst du ein 3-D-Modell des Moleküls, das du in alle Richtungen drehen kannst:
Ethen (C₂H₄) ist ein farbloses, süßlich riechendes Gas. Es schmilzt bei −169,18 °C und siedet bei -103,8 °C.
Das Gas ist als Ausgangsstoff in der chemischen Industrie bei vielen chemischen Reaktionen sehr wichtig. Ethen kann vom Menschen aus Erdöl gebildet werden, auch manche Pflanzen produzieren dieses Gas. Aus Ethen können industriell auch feste Produkte, wie beispielsweise Kunststoffe (Polyethylen), hergestellt werden.
Hier siehst du ein 3-D-Modell des Moleküls, das du in alle Richtungen drehen kannst:
Ethin (C₂H₂) ist ein farbloses Gas. Es sublimiert (wird gasförmig) bei −84,03 °C. Das Gas riecht knoblauchartig. Es kommt nicht in der Natur vor, kann aber industriell aus Erdöl gebildet werden. Ethin wurde als Brennstoff in Karbidlampen verwendet. Diese Lampen wurden früher als Fahrzeugbeleuchtung und in Höhlen genutzt. Verwendung findet es auch als Schweißgas. Aus Ethin können industriell auch feste Produkte, wie beispielsweise Kunststoffe (Polyvinylchlorid), hergestellt werden.
Hier siehst du ein 3-D-Modell des Moleküls, das du in alle Richtungen drehen kannst:
Propan (C₃H₈) ist ein farbloses Gas. Es schmilzt bei -187,7 °C und siedet bei -42,1 °C. Das Gas entsteht bei der Zersetzung anderer Kohlenwasserstoffe. Man kann Propan in Gasflaschen abgefüllt kaufen. Es wird als Autogas, in Gasherden oder in Löt- und Schweißgeräten verwendet. Dort wird es verbrannt. In Wärmepumpen kann es als Kältemittel verwendet werden. Tritt Propan beispielsweise in einem Keller aus, sammelt es sich auf dem Boden an und kann bei Betreten des Kellers zum Ersticken führen.
Hier siehst du ein 3-D-Modell des Moleküls, das du in alle Richtungen drehen kannst:
Merkwissen – Hefteintrag
Der Bau von Kohlenwasserstoffen
Merkwissen – Hefteintrag
Der Bau von Kohlenwasserstoffen

§
Urheber: Digitale Lernwelten GmbH
Übernimm die folgenden Informationen in dein Heft bzw. deinen Hefter!
Hinweis: Für den Hauptschulbildungsgang ist nur die Summenformel verbindlich!
Kohlenwasserstoffe
Die Kohlenwasserstoffe sind eine Stoffgruppe chemischer Verbindungen, die nur aus Kohlenstoff und Wasserstoff bestehen.
Die Atome der Kohlenwasserstoff-Moleküle sind mit der Atombindung verbunden. Es gibt ring- und kettenförmige Moleküle.
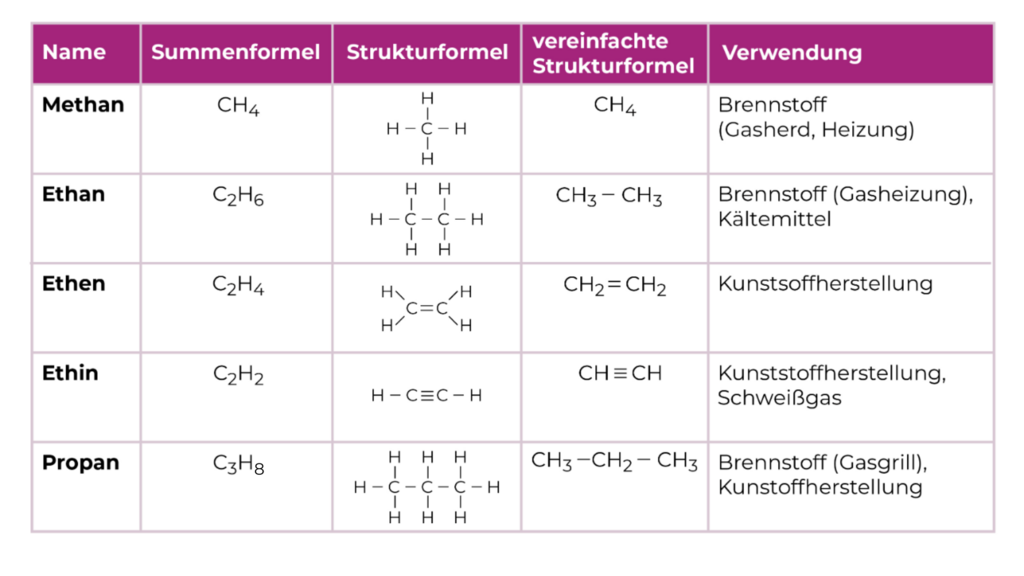
§
© Digitale Lernwelten GmbH
Fachmethode
Steckbrief: Videolehrkraft erklärt
Fachmethode
Steckbrief: Videolehrkraft erklärt
§
© Digitale Lernwelten GmbH
Fachmethode
Mustersteckbrief Wasser
Fachmethode
Mustersteckbrief Wasser

§
© Digitale Lernwelten GmbH
Aufgabe
Steckbrief
Vertiefung für Realschülerinnen und Realschüler
Atombindung
Vertiefung für Realschülerinnen und Realschüler
Atombindung
Wie halten die Atome zusammen?

§
© Christian Haberl
Animation der Atombindung zweier Kohlenstoffatome
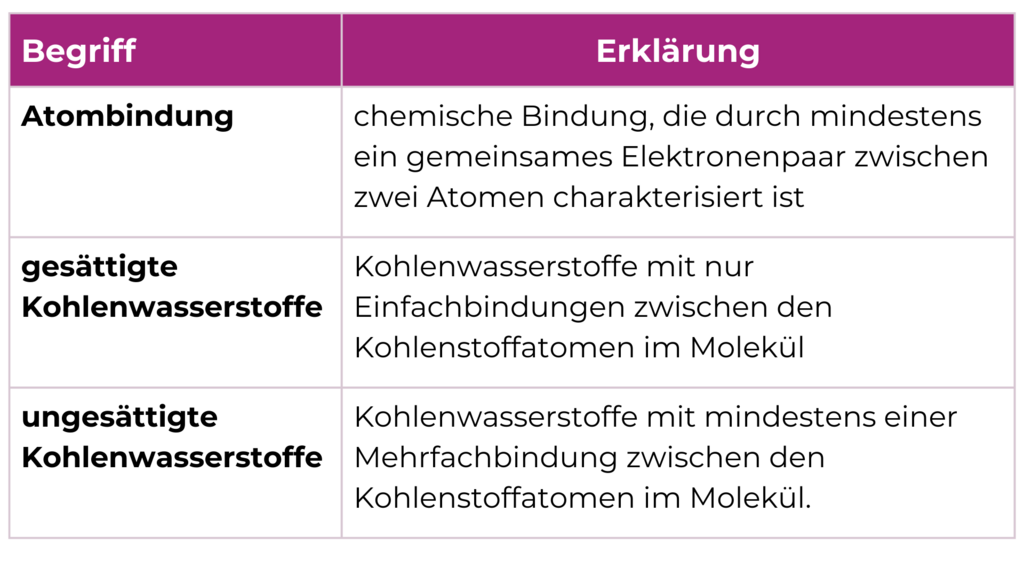
Moleküle
bestehen aus zwei oder mehreren Atomen. Die Atome eines Moleküls sind durch eine oder mehrere Atombindungen miteinander verbunden.
Atombindungen
entstehen durch die Überlappung der Aufenthaltsbereiche der Elektronen (siehe Animation). Beim Kohlenstoffatom gibt es in der Außenhülle des Atoms vier einzelne Außenelektronen. Sie können mit anderen Außenelektronen durch Überlappung der Außenschalen stabile Verbindungen eingehen. Eine Atombindung besteht also immer aus einer Verknüpfung zweier einzelner Elektronen zu einem gemeinsamen Elektronenpaar.
Ein einzelnes Kohlenstoffatom kann wegen der vier einzelnen Elektronen in der Außenhülle bis zu vier Bindungen zu vier anderen Atomen ausbilden.
Bindungstypen bei Kohlenwasserstoffen
Du hast gesehen, dass ein Kohlenstoffatom Bindungen zu vier einzelnen Wasserstoffatomen bilden kann. Zwischen je zwei Atomen gibt es dann eine Einfachbindung (eine Atombindung).
Bei Methan gibt es also vier Einfachbindungen.

§
Ethan – ein Molekül mit Einfachbindungen
Das Molekül Ethan, das aus zwei Kohlenstoffatomen und sechs Wasserstoffatomen aufgebaut ist, besitzt insgesamt sieben Einfachbindungen.
§
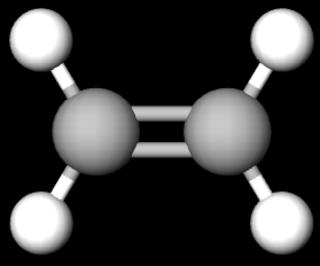
Ethen – ein Molekül mit mehreren Einfachbindungen und einer Doppelbindung
Wenn du dir Ethen anschaust, siehst du, dass dieses Molekül nur vier Wasserstoffatome besitzt. Die beiden Kohlenstoff-Atome besitzen also anders als beim Ethan nicht die maximale Anzahl von sechs Wasserstoffatomen. Ethen bildet dafür eine zweite Bindung zwischen den beiden Kohlenstoff-Atomen aus. Es gibt in diesem Molekül also vier Einfachbindungen zu den Wasserstoffatomen und zwischen den Kohlenstoffatomen eine Doppelbindung (zwei Atombindungen).
Es gibt bei den Kohlenwasserstoffen häufig Moleküle, in denen neben Einfachbindungen zum Wasserstoff auch Doppel- oder sogar Dreifachbindungen (drei Atombindungen), wie beispielsweise bei Ethin, zwischen benachbarten Kohlenstoff-Atomen auftreten. Diese Bindungen werden zusammengefasst auch Mehrfachbindungen genannt.
Vertiefung für Realschülerinnen und Realschüler
Gesättigte und ungesättigte Moleküle
Vertiefung für Realschülerinnen und Realschüler
Gesättigte und ungesättigte Moleküle
Organische Moleküle werden als „gesättigt“ bezeichnet, wenn die Kohlenstoff-Atome eine Bindung mit der maximal möglichen Anzahl an Wasserstoffatomen eingegangen sind. Bei einem Methan-Molekül sind das vier Wasserstoffatome, beim Ethan-Molekül sind es sechs. Voraussetzung dafür ist, dass zwischen den Kohlenstoff-Atomen eines Moleküls nur Einfachbindungen vorliegen oder ein Molekül nur ein Kohlenstoff-Atom enthält, wie beim Methan.
Ein Ethen-Molekül kann aufgrund der Doppelbindung zwischen den Kohlenstoff-Atomen nur vier Wasserstoffatome binden. Die beiden Kohlenstoff-Atome besitzen also anders als das Ethan nicht die maximale Anzahl von sechs Wasserstoffatomen. Daher wird das Ethen-Molekül als „ungesättigtes Molekül“ bezeichnet.
Merkwissen – Hefteintrag
Zusatzwissen Realschule: Atombindung und Moleküle
Merkwissen – Hefteintrag
Zusatzwissen Realschule: Atombindung und Moleküle

§
Urheber: Digitale Lernwelten GmbH
Übernimm die folgenden Informationen in dein Heft bzw. deinen Hefter!
§
© Digitale Lernwelten GmbH
Moleküle bauen und Bindungen analysieren
Ermittle die Anzahl der Wasserstoff-Atome, die in einem Kohlenwasserstoff-Molekül mit drei Kohlenstoff-Atomen maximal gebunden sein können.
Überprüfe anschließend, ob das untersuchte Molekül zwei, drei oder vier Einfachbindungen zwischen Kohlenstoff-Atomen besitzt.
Baue dazu ein Molekül aus drei Kohlenstoffatomen und ergänze mit Wasserstoffatomen. Überprüfe dann in der 3-D-Ansicht, ob das Molekül eine Doppel- oder eine Einfachbindung hat. Du kannst auch noch weiter ausprobieren!
So gehst du Schritt für Schritt vor:
- Öffne die Animationsfläche, indem du auf „Spielwiese“ klickst!
- Baue in dieser Aufgabe Moleküle ausschließlich aus Kohlenstoff und Wasserstoff.
- Wenn es das Molekül in Wirklichkeit gibt, erscheinen über der Struktur ein Name und eine Schaltfläche „3D“.
- Klicke auf die „3D“-Schaltfläche und anschließend auf das Symbol rechts unten.
- Nun kannst du sehen, ob das Molekül Doppel- oder Einfachbindungen besitzt.
§
Phet Interactive Simulations
Du siehst, dass es bei den organischen Molekülen eine große Vielfalt gibt, obwohl diese nur aus wenigen unterschiedlichen Atomen aufgebaut sind. Die unterschiedliche Zusammensetzung führt zu unterschiedlichen Eigenschaften. Beispielsweise gibt es Moleküle, die schwerer sind, und welche, die leichter sind. Außerdem trennen sich größere Kohlenwasserstoff-Moleküle im Gegensatz zu kleinen Molekülen beim Erhitzen nicht so leicht. Deshalb ist Ethan bei Raumtemperatur ein Gas. Das in Benzin enthaltene Oktan, ein Kohlenwasserstoff mit acht Kohlenstoff-Atomen, ist indes eine Flüssigkeit. Kohlenwasserstoffe mit 17 und mehr Kohlenstoff-Atomen sind bei Raumtemperatur sogar fest und können deshalb z. B. zur Herstellung von Kerzenwachs verwendet werden.
Vertiefung für Realschülerinnen und Realschüler
Vertiefung für Realschülerinnen und Realschüler
Aggregatzustände zuordnen
Nachdem du jetzt gesehen hast, dass es Unterschiede im Aufbau der Moleküle gibt, kannst du die oben gezeigten Moleküle nach ihrem Auftreten in der Destillationskolonne zuordnen.
Zum Abschluss: Teste dein Wissen!
Zum Abschluss kannst du dein neu erworbenes Wissen hier noch einmal überprüfen. Beantworte alle Aufgaben!
Zum Abschluss kannst du dein neu erworbenes Wissen hier noch einmal überprüfen. Beantworte alle Aufgaben!