Hier lernst du einige typische Eigenschaften von Kochsalz kennen und erfährst, wie diese mit dem Bau zusammenhängen.

§
Urheber: Hajnalka Mahler
https://pixabay.com/de/photos/kristallisation-chemie-experiment-482971/
Salzkristalle lassen sich leicht selbst züchten
3. Typische Eigenschaften von Kochsalz (Natriumchlorid) und seinen Verwandten
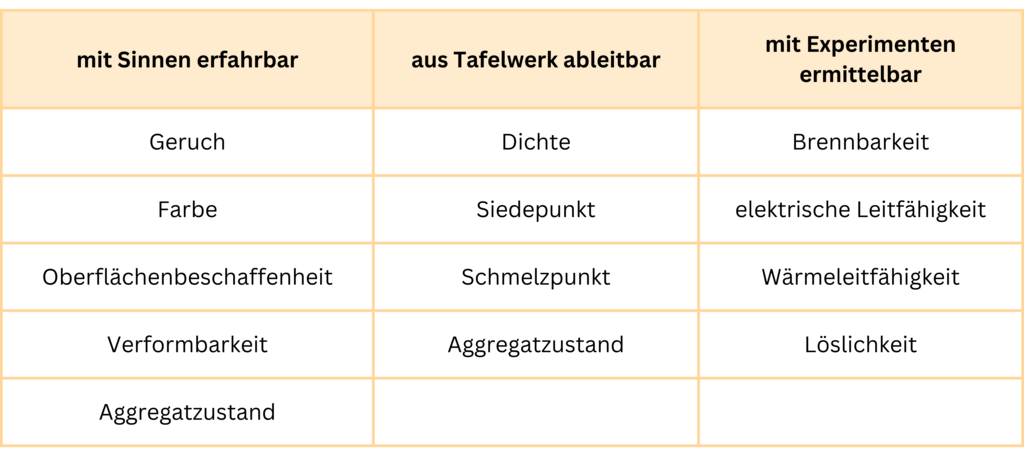
Welche Eigenschaften kennst du schon von Salzen? Eine kleine Hilfestellung bietet dir die Tabelle. Erinnere dich auch an das, was du in den vorangehenden Kapiteln gelernt hast.
§
Urheber: Juliana Zeidler
Einige wichtige Eigenschaften, die alle Salze gemeinsam haben, wirst du im Folgenden genauer untersuchen.
Zusammenhang von Bau und Eigenschaften
Sprödigkeit

§
© Digitale Lernwelten GmbH erstellt mit Canva
Salz
Hast du schon einmal versucht, einen Salzkristall zu verformen? Beobachte doch einmal, was passiert, wenn du einen Löffel auf einen Salzkristall drückst.
Anders als Metalle lassen sich Salzkristalle nicht verformen. Sie zerspringen in kleinere Kristalle.
Warum zerspringt ein Salzkristall?
Folgende Animation zeigt die Spaltung eines Kochsalzkristalls.
§
© Digitale Lernwelten GmbH
Löslichkeit

§
https://pixabay.com/images/id-2152254/
Kartoffelsuppe mit Salz
Wenn wir eine Suppe würzen möchten, greifen wir oft zu Natriumchlorid, auch bekannt als Kochsalz. Doch wie genau löst sich das Salz im Wasser auf?
Der Lösungsvorgang beginnt, wenn Natriumchloridkristalle in Wasser gegeben werden. Sie bestehen, wie du weißt, aus positiv geladenen Natrium-Ionen (Na⁺) und negativ geladenen Chlorid-Ionen (Cl⁻).
Sobald das Natriumchlorid mit dem Wasser in Berührung kommt, beginnen die Wassermoleküle, die Ionen anzuziehen, zu umlagern und aus dem Kristallgitter zu lösen. Auf diese Weise werden die Ionen voneinander getrennt, wodurch sie in der Lösung frei beweglich werden. Das bedeutet, dass Natriumchlorid zu Natrium-Ionen und Chlorid-Ionen zerfällt.
Während des Lösungsvorgangs verteilen sich die Ionen gleichmäßig im Wasser.
Der gesamte Vorgang ist in der folgenden Animation noch einmal dargestellt.
Wähle dein Anforderungsniveau aus und löse die Aufgabe zum Lösungsvorgang der Salze.
Bringe die Bilder und Textbausteine in die richtige Reihenfolge.
Videoexperiment zur Löslichkeit von Natriumchlorid in Wasser
Mit dem folgenden Videoexperiment kannst du die Löslichkeit von Natriumchlorid in Wasser genauer untersuchen.
Zu diesem Versuch erstellst du ein Protokoll. Die folgende Protokoll-Hilfe führt dich schrittweise durch das Experiment. Arbeite dich in Ruhe durch und halte die vorgegebene Reihenfolge genau ein.
§
© Juliana Zeidler
Elektrische Leitfähigkeit

§
Videoexperiment zur elektrischen Leitfähigkeit
Mit dem folgenden Videoexperiment kannst du die elektrische Leitfähigkeit von Natriumchlorid genauer untersuchen. Zu diesem Versuch erstellst du ein Protokoll. Die folgende Protokoll-Hilfe führt dich schrittweise durch das Experiment. Arbeite dich in Ruhe durch das Protokoll und halte die vorgegebene Reihenfolge genau ein.
§
Urheber: Juliana Zeidler
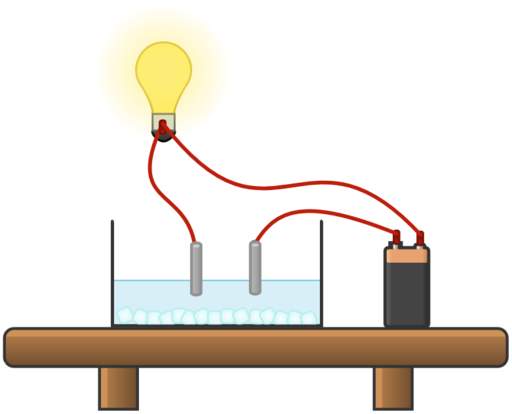
Nach dem Experiment weißt du nun, dass Salze nur in flüssiger oder gelöster Form den elektrischen Strom leiten. Aber warum ist das so?
Dazu müssen wir einmal kurz wiederholen, was wir im alltäglichen Sprachgebrauch unter elektrischem Strom verstehen.
Definition
Elektrischer Strom
Definition
Elektrischer Strom
Unter elektrischem Strom versteht man den gerichteten Transport von frei beweglichen elektrischen Ladungsträgern (Elektronen oder Ionen).
§
Urheber: Juliana Zeidler
Elektrische Leitfähigkeit einer Salzlösung
In festen Salzen sind die Ionen in einem regelmäßigen Kristallgitter in festen Positionen angeordnet. Dadurch sind sie unbeweglich und können den elektrischen Strom nicht leiten.
In Salzlösungen und Salzschmelzen sind die Ionen nicht mehr in einem Gitter angeordnet, sondern frei beweglich. Wenn eine elektrische Spannung angelegt wird, ermöglicht die Beweglichkeit der Ionen den Fluss von elektrischer Ladung durch die Lösung bzw. Schmelze. Die positiv geladenen Ionen wandern zum negativen Pol, während die negativ geladenen Ionen zum positiven Pol wandern. Dieser Ionenfluss ermöglicht den Stromfluss und verleiht der Lösung oder Schmelze ihre elektrische Leitfähigkeit.
Die folgende Animation veranschaulicht dir noch einmal die Leitfähigkeit der Salze.
Aufgabe
Hohe Schmelz- und Siedetemperatur

§
Urheber: Andrea
Salze leiten den elektrischen Strom nur in flüssiger oder gelöster Form.
Salzlampen
Die hohen Schmelz- und Siedetemperaturen der Salze sind auf die spezielle Struktur und die Art der chemischen Bindungen in diesen Verbindungen zurückzuführen.
Salze bestehen aus positiv geladenen und negativ geladenen Ionen, die sich zu einem regelmäßigen Kristallgitter anordnen. Die Anziehungskräfte zwischen den entgegengesetzten Ladungen sind sehr stark und erfordern eine große Menge an Energie, um die Struktur zu überwinden und die Ionen voneinander zu trennen.
Videoexperiment zur Schmelztemperatur Natriumchlorid
Mit dem folgenden Videoexperiment kannst du die Schmelztemperatur von Natriumchlorid genauer untersuchen. Zu diesem Versuch erstellst du ein Protokoll. Die folgende Protokoll-Hilfe führt dich schrittweise durch das Experiment. Arbeite dich in Ruhe durch das Protokoll und halte die vorgegebene Reihenfolge genau ein.
§
© Juliana Zeidler
Merkwissen – Hefteintrag
Merkwissen – Hefteintrag

§
Urheber: Digitale Lernwelten GmbH
Übernimm den folgenden Hefteintrag in dein Heft bzw. deinen Hefter!
Eigenschaften von Kochsalz
- fest (kristallin)
- spröde
- gut löslich in Wasser
- hoher Siede- und Schmelzpunkt
- Elektrische Leitfähigkeit:
- als reiner Feststoff: nicht leitfähig
- in Wasser gelöst: leitfähig
Erklärung zur Leitfähigkeit:
Festes Kochsalz leitet den elektrischen Strom nicht, da die Ionen im Ionengitter nicht frei beweglich sind.
Eine Kochsalzlösung leitet den Strom, da die Ionen frei beweglich sind.
Aufgabe
Steckbrief für Natriumchlorid

§
Urheber: Digitale Lernwelten GmbH
Fertige einen Steckbrief für Natriumchlorid in deinem Heft bzw. deinem Hefter an. Nutze dafür die Steckbriefvorlage von Wasser und die Lerninhalte aus diesem Modulen.
Mustersteckbrief zu Wasser
Mustersteckbrief zu Wasser

§
© Digitale Lernwelten GmbH
Abschlusstest
Überprüfe mit diesen Aufgaben dein Wissen. Viel Erfolg!
Überprüfe mit diesen Aufgaben dein Wissen. Viel Erfolg!
Wähle dein Anforderungsniveau aus und löse den Abschlusstest zum Thema "Salze".
Ein Feuerwerk zum Abschluss
§
Urheber: Majo statt Senf
https://commons.wikimedia.org/wiki/File:Zylinder-Stabrakete.svg
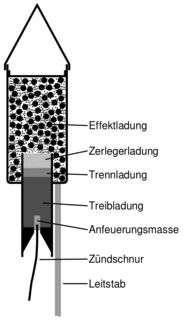
Aufbau einer Stabrakete
Wusstest du eigentlich, dass auch ein Feuerwerk ohne Salze nicht so bunt wäre?
Einige Salzverbindungen erzeugen bei der Verbrennung eine charakteristische Flammenfärbung. In den Effektladungen sind sie in Feuerwerkskörpern enthalten.

§
Urheber: Hegelrast
Von links nach rechts: Lithiumchlorid, Strontiumchlorid, Calciumchlorid, Natriumchlorid, Bariumchlorid, Trimethylborat, Kupferchlorid, Cäsiumchlorid und Kaliumchlorid.
Vielfalt der Salze
Mit folgenden Bildern bekommst du einen kleinen Einblick in weitere Salze.