So unterschiedlich Salze aussehen können, so ähnlich sind sie sich in ihrem Bau. Hier erfährst du, wie Salze aufgebaut sind und warum alle Salze Kristalle bilden.

§
Urheber: Tibor Janosi Mozes
https://pixabay.com/de/photos/mineral-halite-salz-w%C3%BCrfel-stein-6898031/
Salzkristalle unter dem Mikroskop
2. Kochsalz (Natriumchlorid) – ein kristalliner Stoff
Aufbau der Salze

§
Urheber: Hans-Joachim Engelhardt
https://commons.wikimedia.org/wiki/File:HALIT_X_NaCl_Natriumchlorid_W%C3%9CRFEL_KUBUS_50P.jpg
Kochsalzkristall
Alle Salze sind aus Salzkristallen aufgebaut. Diese Kristalle bestehen wiederum aus einzelnen Ionen.
Doch was genau ist eigentlich ein Ion?
Vom Atom zum Ion
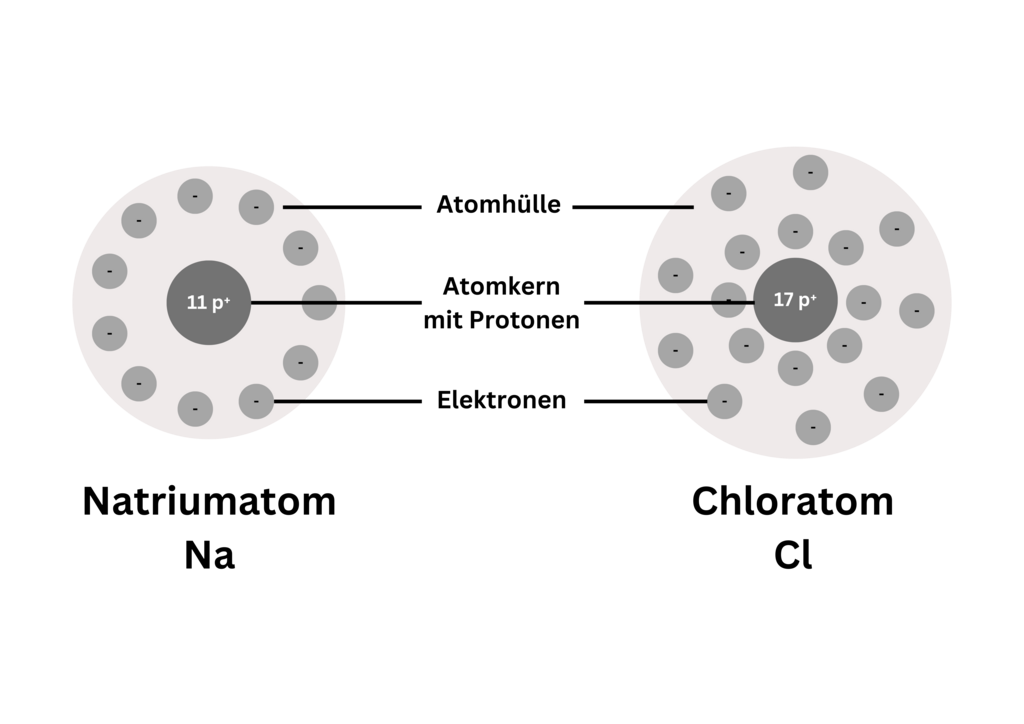
Atome sind elektrisch neutrale Teilchen. Es befinden sich im Atomkern immer genauso viele positive Protonen (p⁺) wie negative Elektronen (e⁻) in der Atomhülle.
Die Abbildung verdeutlicht den Atombau eines Natrium- und Chloratoms:
§
Urheber: Juliana Zeidler
Aufbau eines Natrium- und Chloratoms
Vertiefung für Realschülerinnen und Realschüler
Vertiefung für Realschülerinnen und Realschüler
Die Bildung von Ionen wird dir im folgenden Video einmal am Beispiel von Kochsalz (Natriumchlorid) erklärt.
§
© Digitale Lernwelten GmbH
Definition
Ionen
Definition
Ionen
Ionen sind elektrisch geladene Teilchen.
Es gibt positiv geladene Ionen (Kationen) und negativ geladene Ionen (Anionen).
In den nächsten Tabs findest du einen kleinen Einblick in die Vielzahl der einfach und mehrfach geladenen Ionen.

§
Urheber: Juliana Zeidler

§
Urheber: Juliana Zeidler
Wenn du dir das Video zur Ionenbildung genau angeschaut hast, kannst du diese Aufgaben sicher leicht lösen.
Merkwissen – Hefteintrag
Merkwissen – Hefteintrag

§
Urheber: Digitale Lernwelten GmbH
Übernimm den folgenden Hefteintrag in dein Heft bzw. deinen Hefter!
Aufbau aus Ionen
- Kochsalz besteht aus Ionen.
- Ein Ion ist ein geladenes Teilchen, das mehr oder weniger Elektronen als Protonen hat.
- Es gibt positiv geladene Ionen (Kationen) und negativ geladenen Ionen (Anionen).
- Kochsalz besteht aus positiv geladenen Natrium-Ionen und negativ geladenen Chlorid-Ionen.
Der chemische Name von Kochsalz ist daher Natriumchlorid und die chemische Formel: NaCl
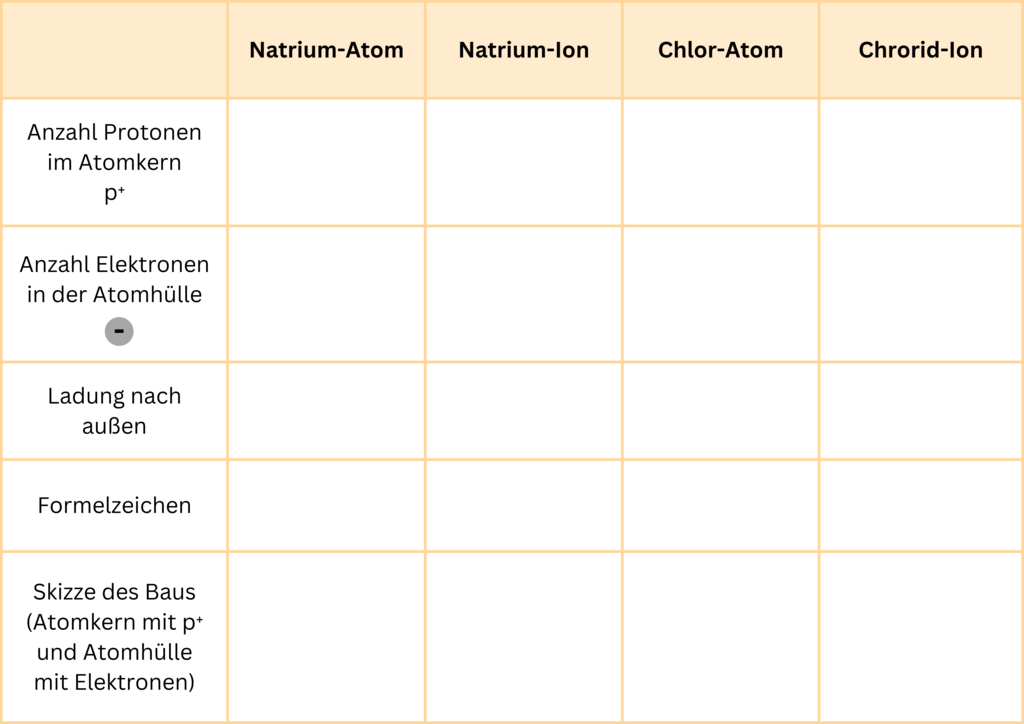
Vergleich von Atom und Ion
Übertrage die Tabelle in dein Heft und vervollständige sie.
§
Urheber: Juliana Zeidler
Vertiefung für Realschülerinnen und Realschüler
Vertiefung für Realschülerinnen und Realschüler
Warum bilden Salze Kristalle?
Alle Salze bestehen aus Ionen. Diese ziehen sich wie zwei unterschiedliche Magnetpole an und ordnen sich zu Kristallstrukturen. Wie das genau funktioniert, wird im folgenden Video erklärt.
§
© Digitale Lernwelten GmbH
Definition
Ionenbindung
Definition
Ionenbindung
Eine Ionenbindung ist eine Art der chemischen Bindung, bei der sich elektrisch positiv geladene Ionen und elektrisch negativ geladene Ionen stark anziehen.
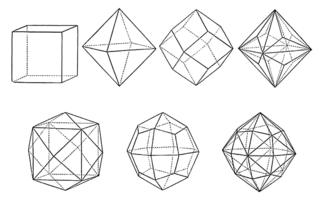
Verschiedene Salze bilden unterschiedliche Kristallgitter aus, sodass kein Kristall dem anderen gleicht. Das hängt mit der Anordnung der Ionen in den Ionengittern zusammen. So ergeben sich die unterschiedlichsten Strukturen.
Übungsaufgaben
Festige dein erworbenes Wissen zur Ionenbindung und Kristallbildung der Salze mit den folgenden Aufgaben.
Aufgabe 1: Der Natriumchloridkristall
Ordne die Natrium- und Chlorid-Ionen in dem leeren Ionengitter an. Beachte, dass sich gleiche Ladungen abstoßen und gegensätzliche Ladungen anziehen.
Aufgabe 2: Die Ionenbindung
Experiment
Salzkristalle züchten
Experiment
Salzkristalle züchten
Lies das folgende Versuchsprotokoll. Darin wird protokolliert, wie man Salzkristalle selbst züchten kann.
Hinweis: Führe dieses Experiment nicht selbst durch, wenn keine erwachsene Person anwesend ist und dich dabei begleitet!
Merkwissen – Hefteintrag
Merkwissen – Hefteintrag

§
Urheber: Digitale Lernwelten GmbH
Übernimm den folgenden Hefteintrag in dein Heft bzw. deinen Hefter!
Die Bindung im Kochsalzkristall
- Aufgrund der entgegen gesetzten Ladung ziehen sich Natrium- und Chlorid-Ionen gegenseitig an.
- Diese Art der chemischen Bindung bezeichnet man als Ionenbindung.
- Die Ionen sind in Form eines Gitters (Ionengitter) regelmäßig angeordnet.
- Natrium- und Chlorid-Ionen sind darin in gleicher Anzahl enthalten.
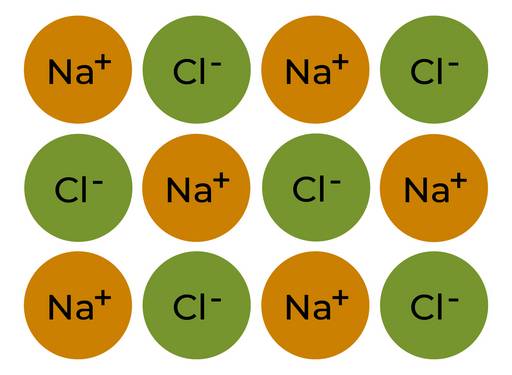
§
© Digitale Lernwelten GmbH
Ionenanordnung im Natriumchloridkristall
Übertrage die Abbildung rechts ebenfalls in dein Heft.