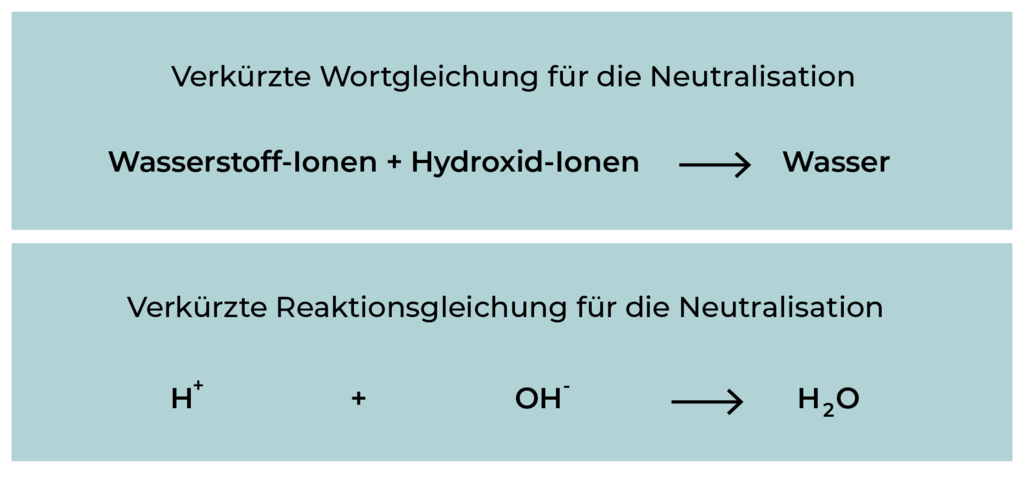
In dem folgenden Versuch wird der Prozess der Neutralisation zunächst schrittweise durchgeführt, indem portionsweise Natronlauge zu Salzsäure gegeben wird. Der zugegebene Farbstoffindikator (Unitest) zeigt jeweils den momentanen pH-Wert an (Vergleich mit der Farbskala).
Die salzsaure Lösung weist die gleiche Konzentration an Wasserstoff-Ionen auf, wie die Natronlauge Hydroxid-Ionen aufweist. Das bedeutet, in 10 ml der Salzsäure sind genau so viele Wasserstoff-Ionen wie in 10 ml Natronlauge Hydroxid-Ionen enthalten sind.
Im Erlenmeyerkolben sind genau 10 ml der Salzsäure, die mit Unitest-Lösung versetzt wurden. Nun werden fast 10 ml Natronlauge hinzugegeben. Es fehlen nur wenige Tropfen, bis genau 10 ml erreicht sind. Die Lösung zeigt weiterhin eine rote Färbung.
Liegt ein Überschuss an Salzsäure vor, so sind noch Wasserstoff-Ionen vorhanden, der Indikator Unitest bleibt rot.
Anschließend wird tropfenweise weiter Natronlauge hinzugegeben.