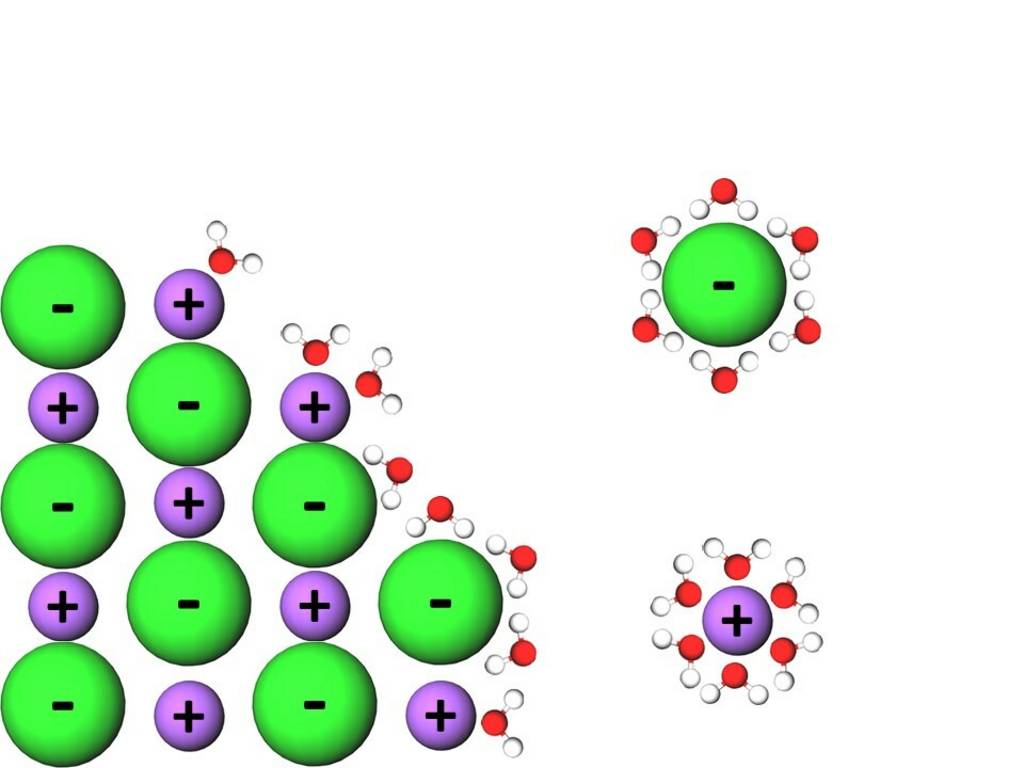
1869 entdeckte der niederländische Physiker Johannes Diderik van der Waals die Ursache der Anziehungskräfte zwischen Atomen beziehungsweise Molekülen.
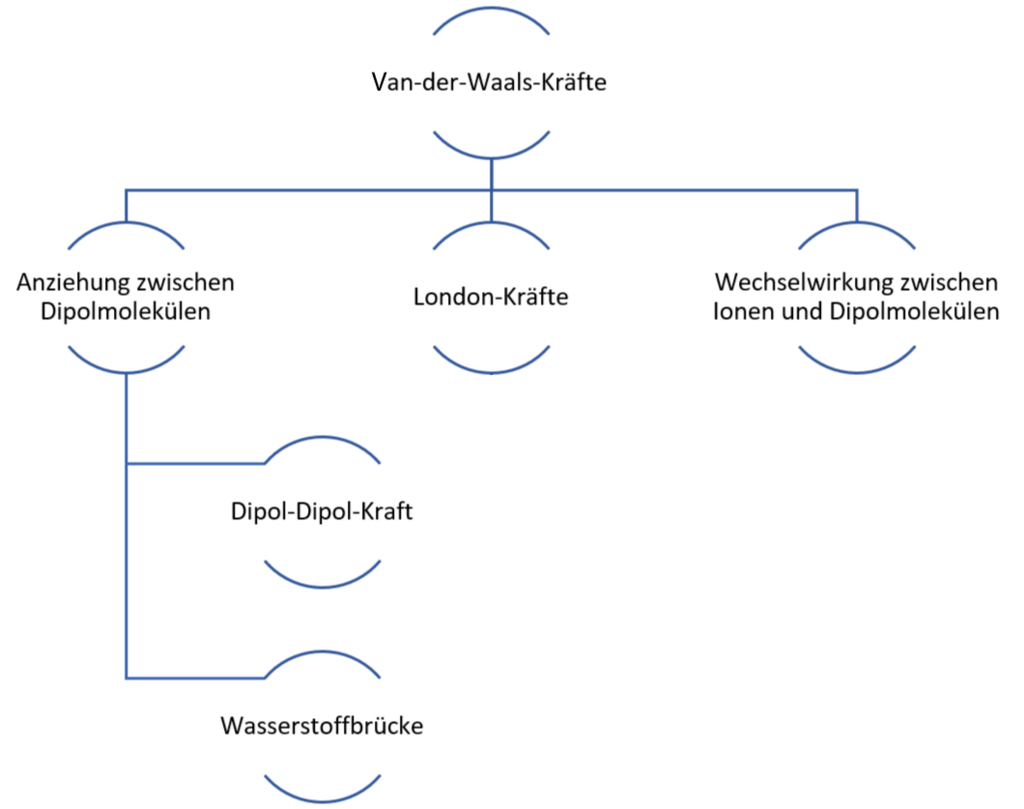
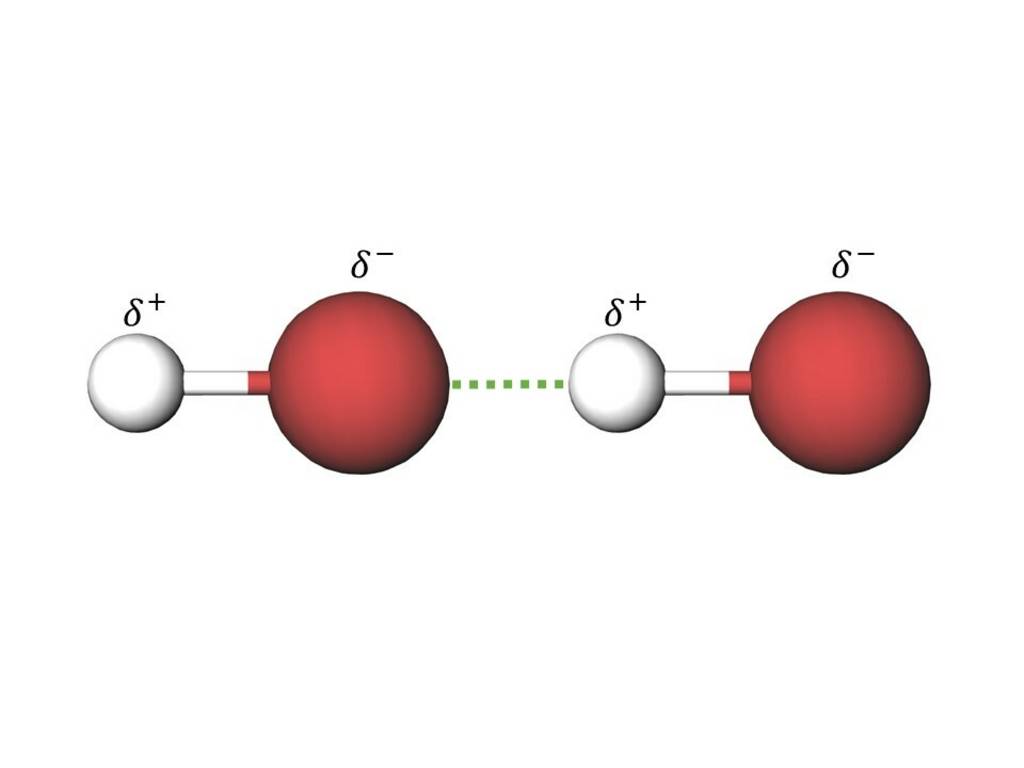
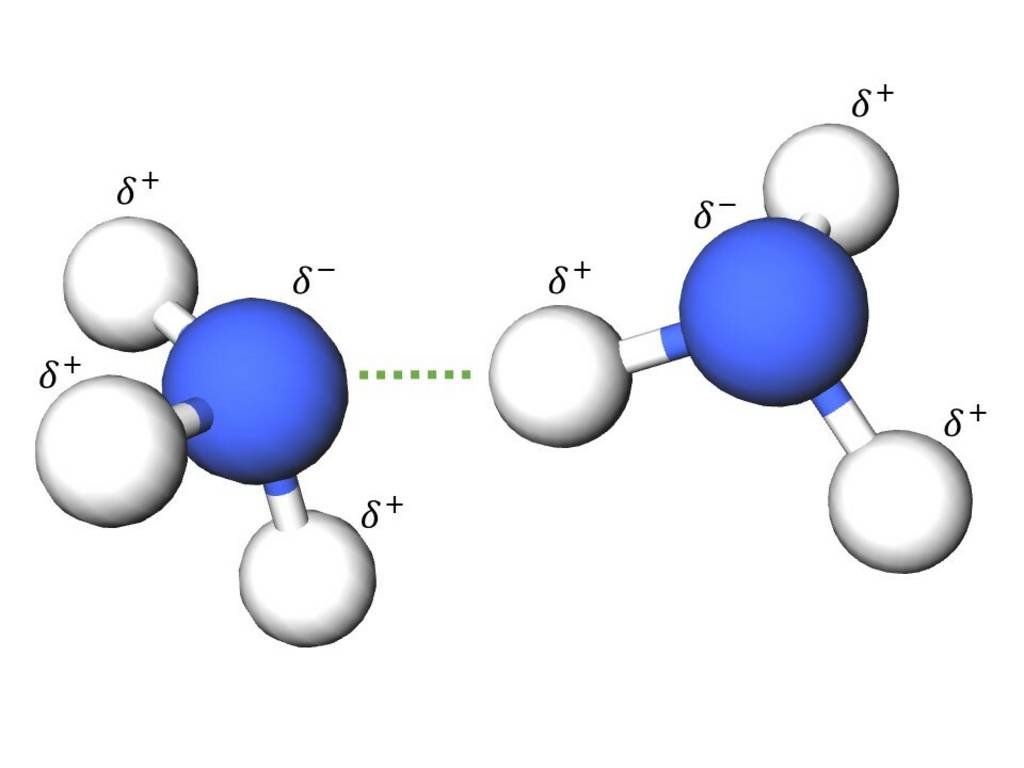
In Anerkennung seiner Leistungen werden in der Chemie seither alle inter- und intramolekularen Anziehungskräfte, welche auf einer elektrostatischen Anziehung eines positiven und eines negativen Pols zweier Teilchen beruhen, unter dem Begriff Van der- Waals-Kräfte zusammengefasst.
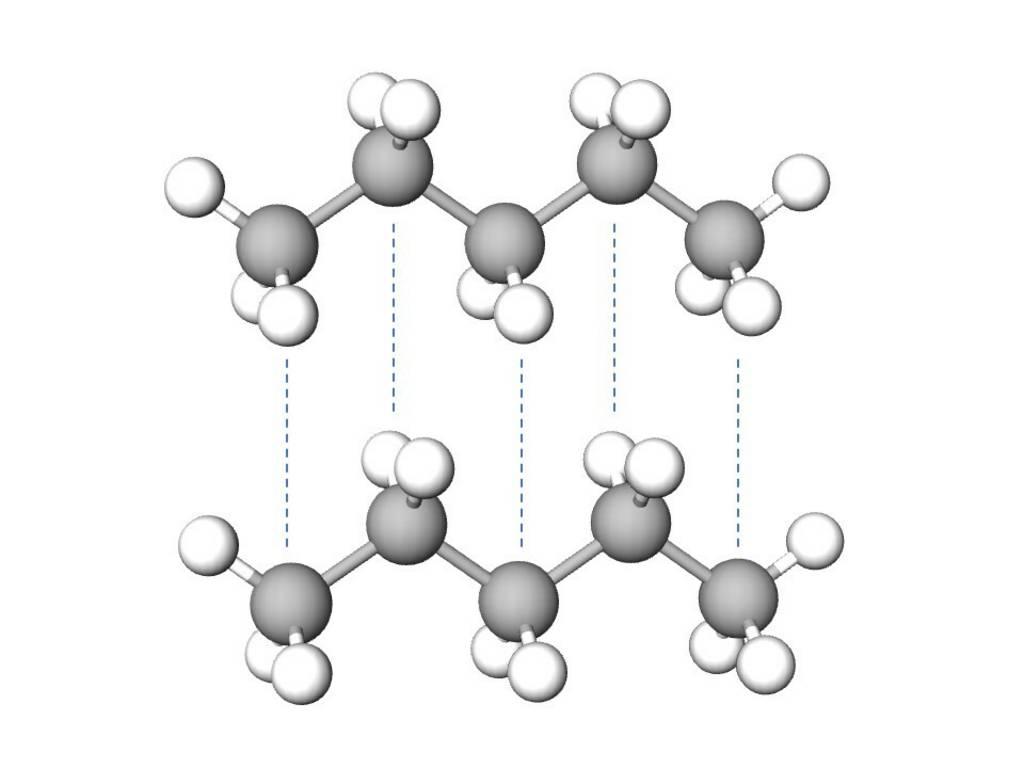
Gewöhnlich wird die Bezeichnung Van-der Waals-Kräfte jedoch nur als Synonym für die London- bzw. Dispersionskräfte, die auch zwischen unpolaren Teilchen auftreten, verwendet.